0
-
An empty cart
You have no item in your shopping cart
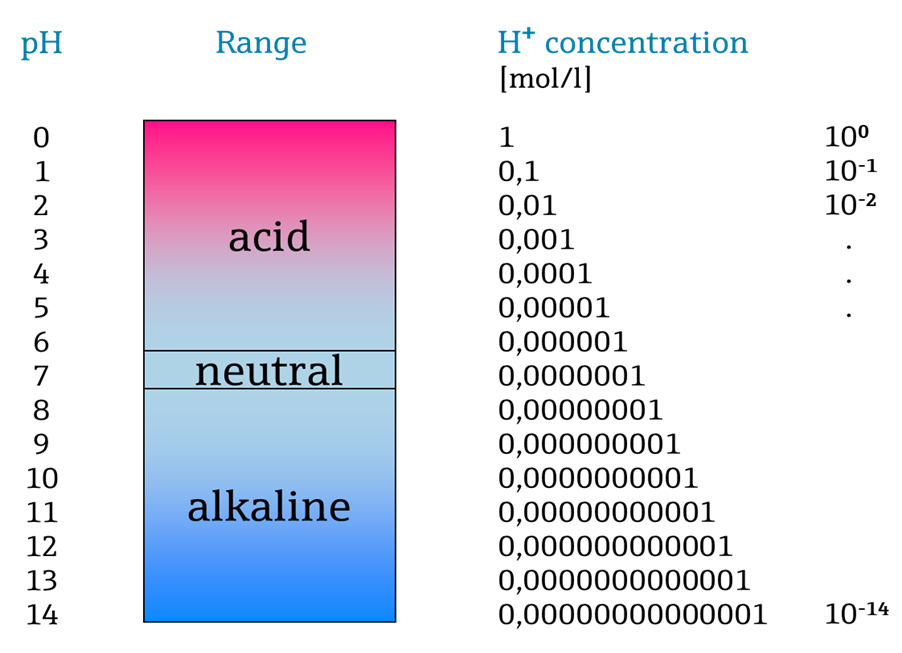
Le pH ou Potentiel d’hydrogène, est une mesure de l’acidité ou de la basicité d’une solution aqueuse. Il est déterminé par la concentration d’ions hydrogène (H+) dans la solution. Le pH est une échelle logarithmique allant de 0 à 14 :
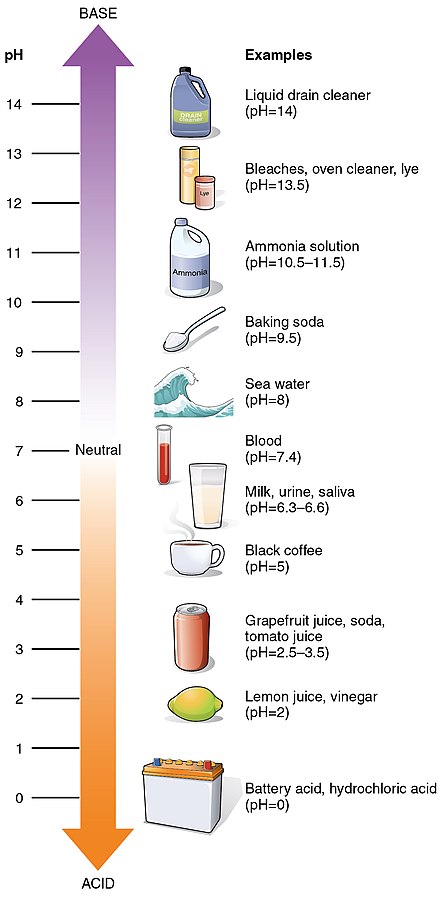
Un pH inférieur à 7 indique une solution acide, où plus il est proche de 0, plus la solution est acide. Un pH égal à 7 est neutre, ce qui signifie qu’il y a un équilibre entre les ions H+ et OH- dans la solution (comme dans l’eau pure à 25°C). Un pH supérieur à 7 indique une solution basique ou alcaline, où plus il est proche de 14, plus la solution est basique.
Pourquoi mesurer le pH ?
Mesurer le pH permet de comprendre et de contrôler de nombreux processus et environnements, assurant ainsi la santé des écosystèmes, l’efficacité des processus industriels, la productivité agricole, et la sécurité dans divers contextes biologiques et chimiques. Mesurer le pH est important pour plusieurs raisons essentielles dans divers domaines scientifiques et industriels :
Environnement et écologie : Le pH de l’eau est crucial pour la santé des écosystèmes aquatiques. Les organismes aquatiques ont des tolérances spécifiques au pH, et des variations importantes peuvent perturber leur équilibre et leur reproduction.
Agriculture : Le pH du sol influence la disponibilité des nutriments pour les plantes. Un pH inadéquat peut affecter la croissance des cultures et le rendement agricole.
Industrie : Dans les processus industriels, le contrôle du pH est souvent critique pour assurer la qualité des produits finis. Par exemple, dans l’industrie alimentaire, pharmaceutique, ou dans le traitement des eaux.
Biologie et médecine : Le pH joue un rôle essentiel dans de nombreux processus biologiques. Par exemple, le pH du sang doit être maintenu dans une plage étroite pour assurer le bon fonctionnement des enzymes et des processus métaboliques.
Eau potable : La qualité de l’eau potable est régulièrement surveillée pour s’assurer que le pH est dans une plage sûre pour la consommation humaine.
Chimie : En chimie, le pH est un indicateur important de la concentration en ions hydrogène (H+) dans une solution, ce qui influence directement les réactions chimiques qui s’y produisent.
Avec quoi mesurer le pH ?
La mesure du pH est effectuée à l’aide d’un pH-mètre ou de papier indicateur pH, qui change de couleur en fonction de la valeur du pH.
La compensation de pH en fonction de la température est un concept important en chimie et en biologie, car le pH d’une solution peut varier avec la température. En effet, le pH d’une solution dépend de la concentration en ions hydrogène (H+) et hydroxyde (OH-) dans l’eau. À des températures différentes, la constante d’ionisation de l’eau (Kw) varie, ce qui peut affecter le pH mesuré.
Compensation automatique : Certains appareils de mesure de pH, comme les pH-mètres de haute précision, intègrent des sondes de température qui ajustent automatiquement les lectures de pH en fonction de la température. Cela permet d’obtenir des valeurs de pH corrigées et plus précises. Ignorer la compensation de température peut entraîner des erreurs significatives dans les mesures de pH, notamment dans des applications critiques telles que les analyses chimiques ou biologiques où la précision est cruciale.
En résumé, la compensation de pH en fonction de la température est essentielle pour obtenir des mesures précises et fiables. Elle peut être réalisée automatiquement par certains équipements modernes ou calculée à l’aide de formules adaptées pour garantir l’exactitude des résultats obtenus.